Дистанційне навчання 2022-2023 н.р.
25.11.2022
Тема:Необоротні і оборотні хімічні процеси.Хімічна рівновага.Принципи Ле Шательє
Опрацюйте матеріал
- випадає осад:
- виділяється газ:
- утворюється слабкий електроліт (наприклад, вода):
- виділяється велика кількість енергії:
Перегляньте відео
Домашнє завдання: опрацювати параграфи 9,10,зробіть конспект
20.10.22
Доброго дня!
Тема:Навчальні проєкти
1.Застосування різних кристалів
2.Використання речовин із різними видами хімічного зв'язку
3.Значення водневого зв'язку для організації структур біополімерів
Одну тему на вибір,підготувати або презентацію, або повідомлення, можна скинути на tanastarodub2@gmail.com
18.10.2022
Тема:Узагальнення та систематизація знань.Самостійна робота
ВИКОНАТИ І СКИНУТИ СЬОГОДНІ
І ВАРІАНТ ( Коваль Б.,Хомченко В.,Гончаренко С.,Донцул К.,Юрченко К)
І РІВЕЬ
Вибрати одну вірну відповідь (0.5 б.)
1. Заряджені
частинки, на які перетворюються атоми, коли віддають або приєднують електрони –
це:
А атоми
Б йони..В протони Г нейтрони.
2. Зв'язок
на основі спільних електронних пар:
А
йонний Б водневий В ковалентний Г металічний.
3. Механізм
утворення зв’язку між атомами за рахунок неподільної електронної пари одного
атома і вільної орбіта лі іншого – це:
А
йонний Б донорно-акцепторний В водневий Г такого не існує.
4. Молекулярні
кристалічні ґратки утворюють речовини з: А металічним зв’язком
Б водневим зв’язком В йонним зв’язком Г ковалентним
зв’язком.
5. Аморфному
стану твердих речовин властиве: А періодична впорядкована структура
Б не чітка напрямленість сусідніх частиок,
відсутність форми
В
газоподібний стан
Г
правильна форма кристалів.
6. Речовини
з йонними кристалічними ґратками: А тверді, нелеткі, крихкі
Б проявляють залежність до
сублімації В мають високу твердість, високу температуру плавлення
Г мають електро- і теплопровідність, металічний блиск.
ІІ рівень Вибрати
одну вірну відповідь (0.5 б.)
7. Вибрати
речовину, утворену ковалентний полярним зв’язком:
А NaCl Б HCl В O2 Г Cu
8. Вибрати
групу елементів, які проявляють схильність до утворення катіонів:
А Cl, Br,F
Б Na,Cu,Fe
В Mg,Cl,Cu
Г N,P,Ca.
9. Укажіть
ряд формул, де містяться тільки йонні сполуки: А KCl,HCl,CO2,MgS Б CaO,ZnCl2,H2S,SO2 B NaCl,CuBr2,AlCl3 Г SO3,H2O,N2,CuS
10. Атом Нітрогену, який віддав неподільну пару електронів для утворення ковалентного зв’язку є:
А акцептором,
Б донором, В металом, Г йоном.
11. Міжмолекулярний
водневий зв'язок спостерігається між молекулами:
А
водню, кисню, азоту
Б
води, спиртів В
вуглекислого газу, чадного газу, Г алканів, алкенів.
12. Прикладами
аморфних речовин є:
А метали Б
солі В полімери Г кремній.
ІІІ рівень
13. Знайдіть
відповідність між формулами речовин і типами хімічного зв’язку, за допомогою
якого вони утворені (2б.)
1 HCl, HBr, NH3
А
Водневий
2 O2, H2, N2
Б Ковалентний полярний
3 Cu, Al, Mg
В ковалентний неполярний
4 NaCl,Ba(NO3)2,FeCl3 Г
Металічний
Д Йонний
IV рівень.(3б.)
14. Визначте,
між якими речовинами відбувається
взаємодія: а) натрій і хлор; б) водень і бром; в) амоніак і хлороводень.
. Складіть
рівняння реакцій та поясніть, який тип кристалічних ґраток мають продукти їх
взаємодії та обумовте фізичні властивості цих речовин.
ВАРІАНТ ІІ (Драгой Д.,Тополенко Р.,Гурбан С.,Ємильянов К.,Олексенко Д)
І РІВЕЬ
Вибрати одну вірну відповідь (0.5 б.)
1. Хімічний
зв'язок між зарядженими частинками на основі електростатичних сил притягання
– це: А
водневий, Б металічний, В
йонний, Г ковалентний.
2. Якщо
між атомами виникли дві спільні електронні пари, то це різновид ковалентного
зв’язку:
А одинарного Б
подвійного В потрійного Г такого не існує.
3. Електростатична
взаємодія в молекулах або між ними за участю атомів Гідрогену:
А водневий зв'язок
Б металічний
зв'язок В
йонний зв'язок Г
ковалентний зв'язок.
4. Для
кристалічних речовин характерно:
А певна форма,
об’єм Б
періодична аморфна структура В
газуватий агрегатний стан Г
розчини проводять електричний струм.
5. Речовини
з атомними кристалічними ґратками: А
добре розчинні у воді Б
здатні до сублімації В
мають металічний блиск, ковкість Г
тверді, нерозчинні у воді.
6. Молекула
кисню утворена:
А ковалентним
полярним зв’язком Б
ковалентним неполярним зв’язком В
йонним зв’язком Г
металічним зв’язком.
ІІ рівень Вибрати
одну вірну відповідь (0.5 б.)
7. Вибрати
речовину, утворену йонним зв’язком:
А F2 Б HCl В KI ГAg
8. Вибрати
групи елементів, які проявляють схильність до утворення аніонів:
А Cl, Br,F
Б Na,Cu,Fe
В Mg,Cl,Cu
Г N,P,Ca.
9. Укажіть
ряд формул, де містяться сполуки, утворені ковалентним неполярним
зв’язком:
А NaCl,Ba(NO3)2,FeCl3 Б O2,H2,N2
В HCl,HBr, NH3 Г Cu,Al,Mg.
10. Йон
Гідрогену, який маючи вільну орбіталь, приєднав неподільну пару
електронів,називають: А
донором Б акцептором В
катіоном Г аніоном.
11. Внутрішньомолекулярний
водневий зв'язок характерний для: групи
А
-ОН у спиртів Б металів В аморфних
речовин Г газів.
12. Парафін
відноситься до:
А кристалів
Б металів В аморфних речовин
Г газів.
ІІІ рівень
13. Знайти
відповідність між назвами речовин і типами кристалічних ґраток, які для них
характерні (2б.)
1. HCl, HBr, NH3
А
Металічна
2. Cu, Al, Mg
Б Атомна
3. NaCl, Ba(NO3)2, FeCl3 В
Молекулярна
4. SiO2, C, Mg 2Si Г
Йонна
5 CuO, NaOH, Al
IV рівень.(3б.)
14. Визначте,
між якими речовинами відбувається взаємодія:
а) водень і
хлор; б) калій і бром; в) кремній і кисень.
Складіть рівняння
реакцій та поясніть, який тип кристалічних ґраток мають продукти їх взаємодії
та обумовте фізичні властивості цих речовин.
11.10.2022
Доброго дня!
Тема:Кристалічний та аморфний стани твердих речовин
Перегляньте відео і нижчий матеріал,зробіть конспект
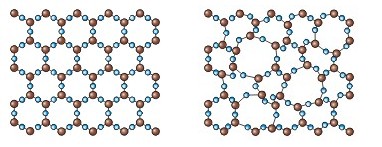





Завдання 1. Алмаз має атомні кристалічні ґратки. Пригадайте або з’ясуйте за додатковими джерелами його властивості.
Завдання 2. Кухонна сіль має йонні кристалічні ґратки. Пригадайте фізичні властивості цієї речовини.
08.09.2022
Тема:Збуджений стан атома.Валентні стани елементів
Опрацюйте матеріал,повторіть
З вивченого ви знаєте, що вища валентність хімічних елементів груп А дорівнює номеру групи, проте існують винятки. Наприклад, Оксиген розташований у VІ групі, проте ніколи не буває шестивалентним. Елемент цієї ж підгрупи Сульфур має сполуки, у яких він шестивалентний, наприклад сульфур(VІ) оксид SO3. Поряд з цим існує сульфур(ІV) оксид SO2 з чотиривалентним Сульфуром і гідроген сульфід Н2S, у якому валентність Сульфуру дорівнює двом.
Електронні конфігурації зовнішніх енергетичних рівнів Оксигену і
Сульфуру однакові:
8O
1s2 2s2 2p4
16S
1s2 2s2 2p6 3s2 3p4 3d0
Графічні електронні формули атомів Оксигену й Сульфуру свідчать,
що в атома Оксигену відсутні вільні енергетичні комірки, тому він не
може перейти в збуджений стан і мати більше двох неспарених (валент-
них) електронів.
Для атома Сульфуру це цілком реально, тому що в нього
є вільні комірки на d-підрівні третього енергетичного рівня. Поглинув-
ши додатково енергію, спарені s- і р-електрони атома Сульфуру займають
вільні комірки на d-підрівні. У збудженому стані графічні електронні
формули Сульфуру такі:
16S*
1s2 2s2 2p6 3s2 3p3 3d1
16S**
1s2 2s2 2p6 3s1 3p3 3d2
Тобто, на відміну від Оксигену, з яким Сульфур входить до однієї підгрупи, електрони зовнішнього енергетичного рівня атома Сульфуру можуть стати неспареними й атом Сульфуру розширює свої валентні можливості.
Атоми неметалічних хімічних елементів можуть переходити в збуджений стан, якщо мають на зовнішньому енергетичному рівні вільні енергетичні комірки, збільшуючи цим самим кількість неспарених електронів.
Виконайте завдання:
Завдання 1. З’ясуйте можливі валентні стани Флуору та Фосфору. Для
цього складіть електронні та графічні електронні формули атомів цих елемен-
тів, розгляньте можливість переходу валентних електронів на більш віддалені
від ядра атома енергетичні підрівні.
Завдання 2. Напишіть формули сполук : а) Флуору з Оксигеном, Флуору
з Гідрогеном; б) Фосфору з Оксигеном, Фосфору з Гідрогеном, що відповіда-
ють можливим валентним станам їх атомів, зазначте ступені окиснення.
Домашнє завдання:опрацювати параграфи 1,2
Вітаю Вас, одинадцятикласники та одинадцятикласниці!
Цього навчального року ви: поглибите й розширите знання з неорганічної та загальної хімії, набуті в попередні роки!
07.09.2022
Тема:Принцип «мінімальної енергії». Електронні формули атомів s-, p-, d-елементів та їхні графічні варіанти





а) 1s22s12p4;
б) 1s12s2;
в) 1s22s12p7.

Немає коментарів:
Дописати коментар
Примітка: лише член цього блогу може опублікувати коментар.